| |
联 系 方 式 |
电 话: |
0371-66559606 |
手 机: |
13838271516 |
|
|
PAC产品系列 |
|
|
 |
制革废水综合一级处理 |
返回上页查看制革废水综合处理目录 |
- 化学氧化还原法的原理是什么?
化学氧化还原法是将废水中呈溶解状态的有毒、有害的无机或有机污染物通过化学反应氧化或还原成低毒、无毒的物质,或者将污染物转化成为易与水分离的物质,聚合氯化铝从而达到去除废水中无机或有机污染物的目的。
废水的化学氧化还原法与废水其他处理方法比较,其运行费用是比较高的。因此这种水处理方法通常用于饮用水的处理、特种工业用水的处理、有毒废水的处理,以及废水的深度处理等。
化学氧化还原过程实际上是电子转移的过程。氧化反应和还原反应总是同时发生的,得失的电子数绝对相等。在氧化还原反应中,反应物的原子或离子失去电子时,这个反应物叫还原剂;反应物的原子或离子获得电子时,这个反应物叫氧化剂。为了便于记忆,氧化还原反应可以概述如下:
还原反应--氧化剂,得电子,价降低,被还原;
氧化反应--还原剂,失电子,价升高,被氧化。
在氧化还原反应中,一种物质氧化数较高的形式叫氧化型,氧化数较低的形式叫还原型。氧化型和还原型组成了该物质的氧化还原电对。
在废水处理中,若有毒污染物处于氧化型;用还原剂将其转变为无毒的还原型,叫做还原处理法;若有毒污染物处于还原型,用氧化剂将其转变为无毒的氧化型,叫做氧化处理法。
氧化剂的氧化能力和还原剂的还原能力是相对的,其强度用相应的氧化还原电位的数值来比较。可以从有关的化学书中查出许多物质的标准电极电位E。E值愈大,该物质的氧化能力愈强;E值愈小,该物质的还原能力愈强。
- 如何用氧化法处理含硫度水?
制革生产过程中排放大量的含硫废水,而含硫废水处理采用氧化法。下面仅就含硫废水的氧化处理法做简要的介绍。
皮革厂排放的含硫废水一般是以钠盐形式存在于废水中的,如Na2S、S、NaHS。在偏酸性废液中,有时还以H2S的形式存在。H2S是一种无色而有剧毒的气体。工业上,在车间空气中其最高允许含量不得超过0.01mg/L。溶于水的H2S也极易向空气中挥发,从而引起大气污染。硫化物在废水排放中的最高允许排放浓度(以S2-计)不得超过lmg/L。
制革含硫废水中的硫是以硫化合物中氧化数最低的氧化型(S2-)存在,因而具有还原性,易被空气中的O2氧化成SO、S4+和S6+。由于制革废水中含硫量不大,回收价值不大,因此可采用空气氧化法除硫。
氧化废水中的硫化物的反应按以下两步进行。
(1)第一步:2S- + 2O2 + H2O → S2O23- + 2OH
2HS- + 2O2 → S2O23- + H2O
半反应式为:S2- = S2+ +4e
O2+4e=2O2-
(2)第二部:S2O23- + 2O2 +2OH- → 2SO24- + H2O
半反应式为:
S2+ = S6+ + 4e
O2 + 4e = 2O2-
由第一步的两个反应式得知,氧化lkg的硫生成硫代硫酸盐理论上需1kg的氧,约相当于3.7m3的空气。在废水处理中,第二步反应只能进行10%,即lkg的硫需0.37m3的空气。综上两者,氧化lkg的硫理论上需要的空气量为4m3左右。在实际废水处理噪作中,空气的供应量为理论值的2倍-3倍。
制革厂通常用硫化碱和石灰进行脱毛操作,因此产生大量的碱性含硫废液。这种废水的pH值在11-13,脱毛废液中硫化物含量在2g/L-3g/L。目前制革厂常用的脱硫方法是空气催化氧化法。其流程如图2-21所示。
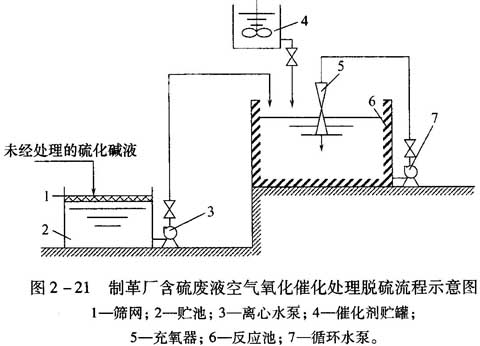
未经处理的含硫废水经筛网1滤去大块的碎皮、毛等固体杂质,集中在贮池2内,再由离心水泵3送至反应池6内,催化剂由催化剂贮罐4经计量后加入反应池6内,开动循环水泵7使废水通过充氧器进行强制循环曝气。这时,氧化反应是靠空气中的氧,在催化剂作用下进行的。废水中的硫化物被空气中的氧气氧化,达到脱硫目的。充氧器的作用是不断提供足够的氧气,使氧气充分地与废水中的硫化物接触并发生反应。催化剂的应用可以有效地提高氧化速度,缩短反应时间。常用的催化剂是锰盐(如MnSO4)。催化剂MnSO4常用投加量为500mg/L,通常曝气时间为3.5h-8h,气水比为15,处理后的出水硫化物(S2-)可以降至3mg/L-5mg/L以下,这部分废水的每吨处理费用在0.5元-0.6元。
- 什么是化学沉淀法?
化学沉淀法是向废水中投加某些化学沉淀剂聚合氯化铝,使之与废水中欲除去的污染物发生化学反应,生成难溶于水的固体生成物(沉淀物),然后再通过固液分离,使污染物从废水中除去的废水处理方法。
化学沉淀法处理废水的工艺流程比较简单,主要有:①沉淀剂聚合氯化铝的配置与投加;②沉淀剂与废水的混合与反应;③固液分离;④泥渣的处置或利用。
化学沉淀法的主要处理对象是废水中的重金属物质(如铜、铬、汞、锌、镍、铅等)和两性元素(如砷、硼等)。在制革废水处理中,主要应用化学沉淀法聚合氯化铝去除废水中的三价铬离子和硫离子。
- 何谓溶解度和溶度积?
某种物质在水中的溶解能力通常用其溶解度表示。溶解度的大小与该物质和溶剂本身性质有直接关系。习惯上把溶解度小于100mg/L的物质称为难溶物质;大于100mg/L的物质称为可溶物质,介于两者之间的,称为微溶物质。严格地讲,没有在水中绝对
不溶的物质。
由于物质的溶解度随温度等条件而变化,又受多种离子平衡的相互牵制,因此引入溶度积的概念。溶度积是在一定温度下,难溶化合物的饱和溶液中,各离子的浓度的乘积。它是一个化学平衡常数,以Ksp表示。难溶物质的溶解平衡可以用下面通式表示:
若有平衡:AmBn=mAn+ + nBm-
则:Ksp=m[An+]m[Bm]n
若非平衡时,IP=m[An+]m[Bm]n
若Ksp>IP,即溶液不饱和,难溶物质将继续溶解;若Ksp=IP;即溶液达到饱和,但此时无沉淀产生;若Ksp<IP即将产生沉淀物质,但当沉淀完后,溶液中所余的离子浓度仍保持在关系上。
如若溶液中存在有多种离子物质,当加入沉淀剂时,必定是离子积先达到溶度积的优先沉淀,这种现象被称为分步沉淀。
溶度积的大小主要取决于各种化学物质的本性,此外,还与物理条件和化学条件有关,其中有温度、负盐效应和同离子效应等。
- 影响溶解度和溶度积的因素是什么?
(1)温度。温度不同,溶度积也随之变化。表2-2为BaSO4的溶解度和溶度积随温度的变化情况。但是,对于溶度积极小的难溶物质而言,其变化的影响不十分明显。通常工程计算中,可以采用25℃的溶度积值。
表2-2 BaSO4的溶解度和溶度积随温度变化
温度/℃ |
0 |
10 |
25 |
50 |
100 |
BaSO4溶解度/mg·L-1 |
1.9 |
2.2 |
2.8 |
3.4 |
3.9 |
BaSO4溶度积Ksp/10-10 |
0.69 |
8.9 |
1.1 |
2.1 |
2.8 |
(2)负盐效应。离子平衡体系对溶度积的影响很大,如在BaSO4饱和溶液中加入不同离子的强电解质(如KNO3),则BaSO4,的溶解度将会增加。这是因为KNO3离解后生成K+和NO3-,它们与Ba2+和SO24-之间也要建立平衡,使BaSO4离解方程向生成Ba2+和SO24-方向移动,结果增加了硫酸钡的Ksp值。外加电解质的浓度愈大,离子所带电荷愈多,负盐效应愈明显,Ksp值也就愈大。如果所投加的聚合氯化铝强电解质的浓度不超过0.01mol/L,负盐效应可以不考虑。但就化学沉淀法而言,负盐效应是不利因素。
(3)同离子效应。当引入的强电解质和难溶物有一相同离子,则后者的溶解度随前者浓度的增加而变小,这种现象叫做同离子效应。同离子效应对化学沉淀有利。
- 如何用化学沉淀法除硫?
制革废水中含有大量的硫化物。而大多数硫化物的溶解度都很小,表2-3列出了难溶硫化物的溶解度。
表2-3 难溶硫化物的溶解度 单位mg/L
物质 |
Na2s |
FeS |
ZnS |
CuS |
PbS |
HgS |
溶解度(100ml溶剂) |
1.5 |
6.2*10-4 |
6.9*10-4 |
3.3*10-5 |
8.6*10-5 |
1.0*1010-6 |
由表2-3可以看出,各种硫化物的溶解度都很小(除Na2S以外)。根据溶解度的大小,硫化物沉淀析出的次序为:Zn2+<Fe2+<Cu2+<Pb2+<Hg2+。
在制革厂废水处理中,就利用硫化物溶解度小的特点,将可溶性的Na2S废水转化成为不可溶性的重金属硫化物的沉淀,然后再实现固液分离,可将重金属硫化物和废水分开。
在脱毛废液的处理过程中,加入聚合氯化铝与Na2S等摩尔的硫酸亚铁(FeSO4),废液立即开始反应,生成黑色沉淀物,废液变得很稠。其反应方程式为:Na2S+FeSO4==FeS↓+Na2SO4
此法在制革厂应用较为普遍。其优点是能较完全地除去废水中的硫化物,但缺点是FeSO4的消耗量比较大。
- 什么是氢氧化物沉淀法?
按照溶解度的大小,可以将金属氢氧化物分为下列三类:
(1)易溶氢氧化物。碱金属(Na、K等)的氢氧化物都是易溶的。
(2)部分难溶氢氧化物。碱土金属(Ca、Mg、Ba等)的氢氧化物溶解度比较小。
(3)难溶氢氧化物。其余的金属氢氧化物大都是难溶的。
氢氧化物来源较广、价格低廉,因此,用氢氧化物沉淀法处理工业废水具有一定的实用价值。制革废水中含铬废液的处理就采用了氢氧化物沉淀法处理技术,即向含铬废液中投加碱性沉淀剂,如白灰、碳酸钠、碳酸氢钠、碳酸钙等,使废液中的Cr3+形成Cr(OH)3沉淀析出。其反应方程式如下:
Cr3+ + 3OH- →Cr(OH)3==H20 + HCrO2 == H2O
+ H+ + CrO2-
根据平衡移动原理,加酸(H+)时,平衡向生成Cr3+方向移动。当pH值在8.5-10时,生成难溶的Cr(OH)3沉淀。当pH值为8.4时,Cr(OH)3的溶解度为零,最利于Cr(OH)3的沉淀析出。
|
|
|